Mesmo sendo uma tendência da atualidade, cada vez mais procurada pelas mulheres que desejam protelar a maternidade com mais segurança, o congelamento de óvulos ainda é motivo de dúvidas para muitas mulheres. Atualmente, as mudanças sociais que aumentam a participação da mulher no mercado de […]
Mesmo sendo uma tendência da atualidade, cada vez mais procurada pelas mulheres que desejam protelar a maternidade com mais segurança, o congelamento de óvulos ainda é motivo de dúvidas para muitas mulheres.
Atualmente, as mudanças sociais que aumentam a participação da mulher no mercado de trabalho e na sociedade como um todo, têm levado muitas mulheres a querer viver a maternidade mais tarde.
Essa realidade associada ao fato de a fertilidade feminina estar restrita ao período entre a puberdade e a menopausa, é o principal motivo pelo qual cada vez mais mulheres têm optado pelo congelamento de óvulos.
Neste texto você vai conhecer melhor o congelamento de óvulos e entender os detalhes da fertilidade feminina que mostram quando é o melhor momento para preservar a fertilidade.
Boa leitura!
Para que a fecundação aconteça – e assim o surgimento de uma nova vida – é necessário que haja a fusão completa de uma célula reprodutiva feminina e uma célula reprodutiva masculina. Chamamos óvulos aos gametas femininos e espermatozoides aos masculinos.
Embora essas células sejam semelhantes em diversos aspectos (como a quantidade de DNA que carregam), muitas são as diferenças que separam óvulos e espermatozoides.
Os óvulos permanecem nos ovários de forma individualizada, envoltos por uma estrutura multicelular que chamamos folículo ovariano. Cada folículo é formado por dois tipos celulares – as células da teca e as células da granulosa – organizadas em camadas como uma cápsula e que interagem com os hormônios sexuais do ciclo reprodutivo.
Essa interação hormonal com as células do folículo ovariano desencadeia todos os processos do ciclo reprodutivo, do recrutamento dos folículos para ovulação ao preparo do endométrio para receber um possível embrião.
Nesse sentido, os espermatozoides são células que não estão envoltas em outras estruturas e a atividade da testosterona sobre a espermatogênese é mediada por células dos próprios testículos.
O momento de formação das células reprodutivas femininas e masculinas é outra diferença entre essas células: os espermatozoides são produzidos continuamente e durante praticamente toda a vida do homem, mas somente após a puberdade e os óvulos são todos produzidos antes do nascimento da mulher, armazenados nos ovários até a menopausa.
Esse estoque limitado de células reprodutivas femininas é chamado reserva ovariana e, após a puberdade, é consumido sistematicamente a cada ciclo reprodutivo pelos processos que envolvem a ovulação. Na menopausa, a reserva ovariana se esgota e a mulher deixa de ser fértil naturalmente.
Na dinâmica hormonal dos ciclos reprodutivos, dois hormônios produzidos pela hipófise são centrais na interação com as células foliculares, que contém os óvulos: as gonadotrofinas FSH (hormônio folículo estimulante) e LH (hormônio luteinizante).
Antes da puberdade, as gonadotrofinas são produzidas em taxas muito baixas e interagem com poucas células foliculares, para manutenção dos níveis mínimos de alguns hormônios, como os estrogênios.
Com a chegada da puberdade, um dos principais papéis das gonadotrofinas é desempenhado na primeira fase do ciclo menstrual, quando as gonadotrofinas recrutam uma grande quantidade de folículos ovarianos para que cresçam e se desenvolvam, com objetivo de participar da ovulação.
Contudo, embora o recrutamento de folículos ovarianos e óvulos seja massivo, apenas um folículo consegue finalizar o processo de crescimento (folículo dominante), enquanto os demais regridem e tornam-se atrésicos. O folículo dominante já maduro se rompe na ovulação, quando a fecundação pode acontecer.
Essa dinâmica faz a reserva ovariana diminuir de forma sempre constante, desde o nascimento, mas de forma muito mais intensa com a chegada da puberdade. Entre a puberdade e a menopausa, que acontece normalmente por volta da 5ª década de vida da mulher, toda a reserva ovariana é consumida e a mulher não pode mais ter filhos.
Além de ser um estoque finito, a qualidade genética da reserva ovariana também decai com a proximidade da menopausa, aumentando a chance de perdas gestacionais e do nascimento de bebês com problemas genéticos, como a síndrome de Down.
O congelamento de óvulos é uma tecnologia desenvolvida em associação com a reprodução assistida, que possibilita a coleta de células reprodutivas femininas e sua conservação e armazenamento por tempo ilimitado.
Para isso, as células reprodutivas passam pelo processo de vitrificação, uma técnica de congelamento rápido em nitrogênio líquido, que preserva as funções celulares com chances bem reduzidas de formação de cristais, que podem danificar as células preservadas.
Os óvulos são coletados por aspiração folicular, após a estimulação ovariana, e armazenados em recipientes contendo um meio nutritivo e protetivo, fundamental para a conservação desse material em baixíssimas temperaturas.
Os óvulos criopreservados por vitrificação, assim como o sêmen e os embriões que também podem ser criopreservados, são conservados por tempo ilimitado e podem ser utilizados logo após seu descongelamento, em qualquer momento.
O congelamento de óvulos pode ser feito por qualquer mulher que deseja adiar a maternidade com mais segurança, evitando as possibilidades de encontrar dificuldade para engravidar com mais idade e diminuindo as chances de problemas genéticos nos bebês.
Contudo, aconselha-se que a coleta de óvulos para congelamento seja feita antes dos 35 anos, quando a reserva ovariana começa a se degradar mais intensamente.
Além disso, as mulheres que realizam o congelamento de óvulos podem utilizar suas células reprodutivas para ter filhos até os 50 anos. Após esse período, a dinâmica dos hormônios sexuais mostra-se reduzida em função da menopausa, o que pode comprometer a gestação.
O congelamento de óvulos também é indicado para mulheres que recebem um diagnóstico de câncer e precisam passar pelos tratamentos de quimioterapia e radioterapia, que oferecem alto potencial de dano à reserva ovariana.
Atualmente, a preservação oncológica da fertilidade é uma ferramenta no enfrentamento do câncer e suas consequências, melhorando as perspectivas da vida após a cura da doença, cada vez mais comum hoje.
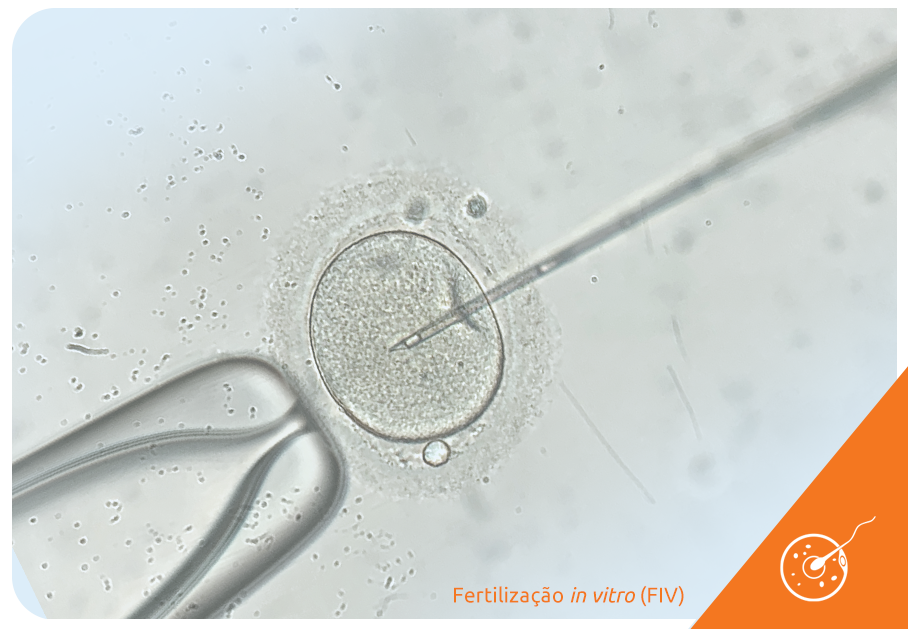
É importante lembrar que o congelamento de óvulos é parte das técnicas de reprodução assistida, mais especificamente da FIV (fertilização in vitro), ou seja, a mulher que opta pela preservação da fertilidade com o congelamento de óvulos só pode engravidar utilizando esse material na FIV.
Para coletar as células reprodutivas femininas que serão congeladas, a mulher passa pela estimulação ovariana e indução da ovulação de forma semelhante aos tratamentos tradicionais com a FIV. Nesta etapa, a mulher recebe doses diárias de uma medicação hormonal para induzir o recrutamento e crescimento de um grande número de folículos.
Esse processo é monitorado por ultrassonografia pélvica transvaginal, que indica o momento ideal para induzir a ovulação e coletar os óvulos, por aspiração folicular – um procedimento simples, em que uma agulha é introduzida por via transvaginal até os ovários, puncionando os folículos que contêm os óvulos.
Esse material é então encaminhado para o congelamento e fica armazenado até que a mulher manifeste desejo de engravidar.
Neste momento, os óvulos são descongelados e o sêmen do parceiro é coletado, para que a fecundação seja feita em laboratório. Os embriões obtidos são então observados no cultivo embrionário e transferidos para o útero, que precisa estar receptivo.
Leia mais sobre o congelamento de óvulos tocando neste link.
MaisChamamos sêmen o material expelido na ejaculação, formado por líquidos glandulares e células reprodutivas – e por isso fundamental para a fertilidade masculina. Enquanto os líquidos do sêmen são compostos pelas secreções das três glândulas anexas ao aparelho reprodutor masculino – vesículas seminais, glândulas bulbouretrais […]
Chamamos sêmen o material expelido na ejaculação, formado por líquidos glandulares e células reprodutivas – e por isso fundamental para a fertilidade masculina.
Enquanto os líquidos do sêmen são compostos pelas secreções das três glândulas anexas ao aparelho reprodutor masculino – vesículas seminais, glândulas bulbouretrais e próstata –, os espermatozoides são células únicas, com a função exclusiva de fecundar o óvulo.
Estruturalmente, o espermatozoide é formado por cabeça, contendo núcleo e acrossomo, peça intermediária, com uma grande quantidade de mitocôndrias, e cauda, responsável pela motilidade desta célula. A integridade de todas essas estruturas é fundamental para que o espermatozoide consiga desempenhar seu papel no processo reprodutivo.
A motilidade espermática é um dos aspectos funcionais do espermatozoide e, justamente por atuar na locomoção destas células dentro do aparelho reprodutivo feminino, é fundamental para o encontro com o gameta feminino.
Problemas na motilidade espermática podem se refletir em dificuldades para engravidar a parceira e podem estar associadas a outras doenças, que provocam sintomas diversos, além da infertilidade.
Neste texto vamos abordar a motilidade espermática e sua relação com a fertilidade masculina, além das possibilidades de tratamento – incluindo a reprodução assistida.
Boa leitura!
Em linhas gerais, a motilidade espermática é a capacidade de o espermatozoide locomover-se pela propulsão da cauda mantendo o controle da direção de seu nado, após a liquefação do sêmen.
Este aspeto espermático pode ser avaliado sob dois pontos de vista: a capacidade de vibração da cauda e se este movimento leva o espermatozoide a se locomover “para frente”.
Ou seja, a motilidade espermática deve ser progressiva para a maior parte dos espermatozoides contidos no sêmen de uma ejaculação, para que este aspecto seja considerado normal na avaliação da fertilidade masculina.
Além da motilidade espermática, diversos outros fatores do sêmen podem ser analisados e todos são comparados com os parâmetros de normalidade espermática estabelecidos pela Organização Mundial da Saúde (OMS).
Segundo a OMS, os parâmetros de normalidade da motilidade espermática são estes:
Na fecundação por vias naturais – ou seja, em que não há participação das técnicas de reprodução assistida –, o encontro entre o óvulo e os espermatozoides acontece normalmente com as relações sexuais durante o período fértil da mulher, nas tubas uterinas.
Para alcançar o óvulo, os espermatozoides são lançados no interior do corpo da mulher com a ejaculação, junto aos líquidos do sêmen, que nutrem os espermatozoides e protegem estas células da acidez típica do canal vaginal.
Pouco tempo após a ejaculação, o sêmen perde viscosidade e torna-se mais liquefeito, facilitando a propulsão dos espermatozoides pelos movimentos da cauda. Neste momento, os espermatozoides que conseguem nadar de forma mais veloz e direcionada (progressiva) têm mais chance de chegar ao encontro do óvulo e disputar a fecundação desta célula.
A motilidade espermática, portanto, é um aspecto fundamental para a fertilidade masculina, sendo por isso um aspecto seminal importante na avaliação da capacidade reprodutiva do homem.
Astenozoospermia é o nome técnico para a condição em que o homem apresenta problemas seminais relacionados à diminuição da motilidade espermática. Identificada pelo espermograma, a astenozoospermia pode ser uma consequência de diversas doenças e condições, diagnosticadas por outros exames.
Os problemas na motilidade espermática podem ter origem em alterações genéticas que prejudicam a espermatogênese (formação dos espermatozoides), mas também por doenças infecciosas, especialmente DSTs (doenças sexualmente transmissíveis) e outros microrganismos envolvidos com quadros de uretrite, epididimite, orquite e prostatite.
A varicocele, uma doença genética que prejudica o fluxo sanguíneo no cordão espermático, também pode provocar problemas na motilidade espermática, embora a azoospermia seja uma consequência mais comum da doença. Nestes casos, as alterações na temperatura testicular podem afetar a formação da cauda, causando astenozoospermia.
A motilidade espermática pode ser afetada também por hábitos cotidianos pouco saudáveis, como má alimentação, uso excessivo de álcool e drogas, além do tabagismo.
Homens com mais de 50 anos têm mais chance de apresentar uma diminuição na motilidade espermática naturalmente, em função da idade.
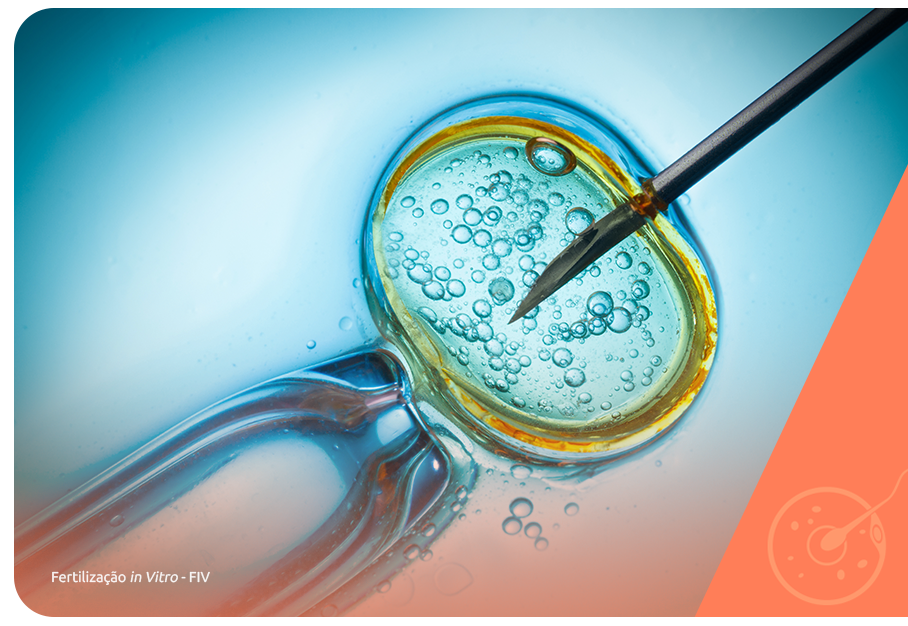
Além dos tratamentos primários para as causas da redução na motilidade espermática, quando disponíveis, a reprodução assistida também pode ser indicada para reverter a infertilidade masculina nestes casos.
As técnicas indicadas são a IA (inseminação artificial) e a FIV (fertilização in vitro) e a escolha entre elas deve ter como base uma avaliação completa das condições reprodutivas do casal e de seu histórico reprodutivo até o momento do tratamento com a reprodução assistida.
Tanto na IA como na FIV é possível conseguir espermatozoides com uma amostra de sêmen obtida por masturbação e com auxílio das técnicas de recuperação espermática: PESA, MESA, TESE e Micro-TESE.
Com a coleta de espermatozoides, independente da metodologia empregada, esse material é submetido ao preparo seminal em laboratório, que seleciona as melhores células reprodutivas para a fecundação.
Na IA, espera-se que a fecundação aconteça nas tubas uterinas, após a inseminação dessa amostra selecionada de sêmen no útero, durante o período fértil da mulher. Já na FIV, os óvulos são coletados e a fecundação ocorre em laboratório, com a transferência dos embriões para o útero, após o cultivo e seleção embrionária.
Leia mais sobre infertilidade masculina tocando neste link.
MaisO desenvolvimento da tecnologia do ultrassom possibilitou inúmeros avanços na ciência, mas especialmente na medicina diagnóstica com a criação da ultrassonografia, um dos exames mais realizados no mundo por sua grande abrangência. Nesse exame, um transmissor emite ondas, cuja frequência é menor que as sonoras, […]
O desenvolvimento da tecnologia do ultrassom possibilitou inúmeros avanços na ciência, mas especialmente na medicina diagnóstica com a criação da ultrassonografia, um dos exames mais realizados no mundo por sua grande abrangência.
Nesse exame, um transmissor emite ondas, cuja frequência é menor que as sonoras, em direção à estrutura que se deseja observar. O transmissor é conectado a um receptor, que identifica a relação entre as ondas emitidas e seus ecos, que voltam de formas específicas quando encontram tecidos de diferentes densidades.
Os ecos são registrados por um aparelho externo conectado a um monitor, que cria imagens em tempo real com base nas respostas das ondas sonoras.
O ultrassom é um exame indicado para visualização dos órgãos localizados nas cavidades abdominal e pélvica, além de tendões, ligamentos e músculos.
A medicina reprodutiva se beneficia do ultrassom não somente nos processos diagnósticos que precedem a indicação das técnicas, mas também para a realização dos procedimentos que ajudam casais com as mais diversas demandas reprodutivas a terem filhos.
Continue a leitura deste texto e entenda melhor o papel do ultrassom na reprodução assistida. Aproveite!
As técnicas de reprodução assistida são divididas segundo a complexidade dos procedimentos empregados para se chegar à gestação em alta e baixa complexidade. O local em que a fecundação acontece e o nível de manipulação e seleção dos gametas são as duas principais variáveis na determinação da complexidade de cada uma.
A indicação da mais adequada em cada caso depende de um acurado processo de investigação diagnóstica, que estabelece as causas da infertilidade conjugal e considera as restrições de cada técnica.
Além do tratamento da infertilidade, a reprodução assistida também atende a outras demandas reprodutivas, como a preservação da fertilidade e o atendimento de casais homoafetivos que desejam ter filhos.
Também chamada de coito programado, a RSP é a técnica menos complexa oferecida pela medicina reprodutiva, indicada para casos de infertilidade feminina leve por problemas ovulatórios e na ausência de qualquer doença reprodutiva masculina.
Nessa técnica, a mulher passa pela estimulação ovariana e indução da ovulação para determinação do período fértil, quando o casal é aconselhado a manter relações sexuais, pois, há maior chance de engravidar.
Embora seja considerada uma técnica de baixa complexidade e que atende às mesmas demandas da RSP, a inseminação artificial é, porém, mais abrangente e pode ser indicada para alguns casos de infertilidade masculina e para casais homoafetivos femininos.
Assim como a RSP, a mulher também passa pelas etapas iniciais que determinam o período fértil, porém simultaneamente é realizada a coleta de sêmen e a seleção de amostras contendo uma concentração alta de espermatozoides, inseridos diretamente no útero durante o período fértil.
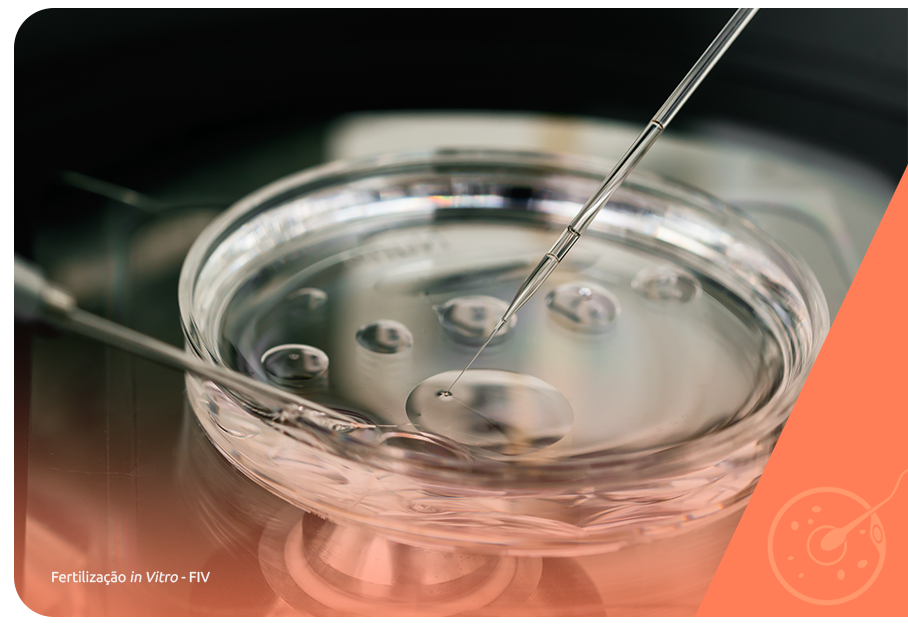
A FIV é a técnica mais complexa, principalmente porque permite a fecundação em laboratório com gametas masculinos e femininos coletados previamente. Os embriões são cultivados de 3 a 6 dias e em seguida transferidos para o útero devidamente preparado para a nidação.
A etapa inicial da FIV é comum às técnicas de baixa complexidade, porém a estimulação ovariana é mais robusta, já que é preciso obter um número maior de óvulos para aumentar as chances de sucesso. A maior parte das demandas reprodutivas atualmente podem ser atendidas pela FIV.
O ultrassom é um dos exames mais solicitados no mundo para o diagnóstico de diversas enfermidades, e especialmente na medicina reprodutiva pode ser utilizado para diagnosticar problemas de saúde femininos e masculinos.
Para as mulheres, as modalidades mais solicitadas são o ultrassom transvaginal e o ultrassom pélvico abdominal, que fornecem imagens em diferentes graus de detalhamento das condições de órgãos como o útero, tubas uterinas e ovários.
Esses exames são utilizados principalmente para identificar malformações anatômicas e doenças que provocam a formação de massas celulares anormais ou processos inflamatórios mais severos.
Entre as doenças e alterações que podem ser inicialmente identificadas pelo ultrassom e envolvidas com quadros de infertilidade, destacamos:
A varicocele é uma doença masculina que pode provocar infertilidade por azoospermia não obstrutiva, cujo diagnóstico é feito principalmente pelo ultrassom testicular com Doppler, que avalia o fluxo sanguíneo do cordão espermático e localiza as veias varicosas.
Além de participar do diagnóstico que precede a indicação das técnicas de reprodução assistida, o ultrassom também é parte de todos os procedimentos disponíveis atualmente, com o monitoramento da etapa de estimulação ovariana e indução da ovulação.
A estimulação ovariana é feita com a administração de doses diárias de hormônios que induzem o recrutamento e crescimento dos folículos ovarianos. Esse processo sempre é monitorado por ultrassom transvaginal, que acompanha as fases sinalizando o melhor momento para iniciar a etapa seguinte do tratamento.
Na RSP e na IA, o monitoramento ultrassonográfico é capaz de predizer o período fértil, que na primeira técnica sinaliza ao casal que mantenha as relações sexuais programadas e, na segunda, aponta o momento ideal para a inseminação propriamente dita.
Como na FIV a fecundação acontece fora do corpo da mulher, o acompanhamento da ovulação, no início do tratamento tem como objetivo determinar o momento ideal para a coleta dos folículos maduros, feita por aspiração folicular para posterior extração dos óvulos neles abrigados.
Tanto nos tratamentos com a reprodução assistida, como para os casais que estão tentando engravidar de forma natural, o ultrassom auxilia na confirmação da gravidez, além dos exames laboratoriais que medem a concentração de beta hCG.
Ao longo de toda a gestação, o ultrassom também é um exame recorrente, que acompanha o crescimento e desenvolvimento do bebê, sendo fundamental para diversos diagnósticos pré-natais.
Leia mais sobre a FIV tocando neste link.
MaisQuando falamos sobre infertilidade masculina, um dos primeiros fatores a ser analisado é o sêmen, ou melhor a qualidade espermática. Isso porque a maior parte dos casos de infertilidade masculina acontece devido a alguma deficiência relacionada ao sêmen, seja em sua composição, qualidade ou mesmo […]
Quando falamos sobre infertilidade masculina, um dos primeiros fatores a ser analisado é o sêmen, ou melhor a qualidade espermática. Isso porque a maior parte dos casos de infertilidade masculina acontece devido a alguma deficiência relacionada ao sêmen, seja em sua composição, qualidade ou mesmo quantidade, principalmente dos espermatozoides.
O sêmen ou esperma é um composto, formado pelos líquidos secretados pelas vesículas seminais, glândulas bulbouretrais e próstata somados aos espermatozoides, que são os gametas masculinos.
Alguns exames, como o espermograma, permitem avaliar a fertilidade masculina pela análise desses aspectos e a comparação dos resultados com um conjunto de parâmetros de normalidade, estabelecidos por consenso, na comunidade médica internacional e pela Organização Mundial da Saúde (OMS).
Siga na leitura do texto para entender mais sobre os diferentes aspectos do espermograma, quando é solicitado e o que este exame analisa.
Boa leitura!

O espermograma é um exame laboratorial, sendo a amostra coletada por masturbação, e imprescindível na avaliação da fertilidade masculina. No exame, uma amostra de sêmen é avaliada do ponto de vista quantitativo e qualitativo, analisando aspectos específicos da composição do ejaculado e buscando estimar a fertilidade do homem em um determinado momento de sua vida.
Além de avaliar a capacidade reprodutiva do homem, com a análise da qualidade do sêmen e da saúde dos espermatozoides, o espermograma também pode ser solicitado em outras situações, como a verificação do sucesso de vasectomia ou da reversão deste procedimento.
Algumas doenças infecciosas, especialmente quando afetam as estruturas reprodutivas e a uretra – que compartilha funções com o aparelho urinário – também podem ser identificadas pelo espermograma, que sinaliza a presença de células imunológicas, indicando infecções.
No espermograma, o sêmen é analisado por procedimentos laboratoriais que observam este composto sob o ponto de vista de seus aspectos macroscópicos e microscópicos.
A análise macroscópica do sêmen no espermograma tem como objetivo observar aspectos visíveis a olho nu, como viscosidade, quantidade (volume), cor e tempo de liquefação – quando o sêmen perde viscosidade e torna-se líquido – de uma amostra do líquido ejaculado.
O pH, que indica se o sêmen é ácido ou alcalino, também é considerado um parâmetro macroscópico, avaliado pelo espermograma.
O homem com suas funções reprodutivas preservadas apresenta um sêmen com pH igual ou inferior a 7,2 e libera em média 1,5ml de sêmen por ejaculação, que é inicialmente esbranquiçado e viscoso, tornando-se líquido e transparente em até 60 minutos.
Já a análise microscópica do sêmen, como o próprio nome sugere, visa avaliar o líquido ejaculado em seus aspectos invisíveis a olho nu, ou seja, com o auxílio de um microscópio avalia os espermatozoides e a presença de outras células.
Aspectos como a concentração total de espermatozoides na amostra de sêmen coletada e concentração por volume proporcional, bem como vitalidade, motilidade (capacidade de locomoção adequada dos espermatozoides) e morfologia dessas células são avaliados pela análise dos aspectos microscópicos, no espermograma.
Além disso, a análise microscópica do espermograma permite a detecção de leucócitos no sêmen, o que pode indicar uma infecção ativa, provavelmente instalada nos testículos (orquite), nos epidídimos (epididimite) e na uretra (uretrite).
Segundo os parâmetros de normalidade da OMS (2020) para os aspectos microscópicos do sêmen, o ejaculado normal contém uma média de 16 milhões de espermatozoides por ml de sêmen, que pode apresentar uma contagem total de pelo menos 39 milhões de espermatozoides, ao todo.
A organização também estabelece que no sêmen saudável mais de 54% dos espermatozoides estão vivos e ativos, ao menos 30% dos espermatozoides apresentam a motilidade (inclusive progressiva) preservada e 4% dessas células são morfologicamente normais.
Os parâmetros seminais são aspectos específicos da composição do sêmen, observados pelo espermograma, com objetivo de avaliar as condições em que se encontra a capacidade reprodutiva do homem.
Estes parâmetros foram estabelecidos pela OMS e os resultados do espermograma devem ser comparados a eles:
Cada um desses aspectos é fundamental para que a taxa de sobrevivência dos espermatozoides – ao longo de todo o trajeto percorrido pelo sêmen para que a fecundação aconteça – seja satisfatória e não comprometa as chances naturais de engravidar a parceira.
Os líquidos glandulares formam o ambiente em que os espermatozoides estão embebidos e devem possuir características específicas para que estas células sobrevivam após a ejaculação, especialmente no interior do corpo da mulher.
Normalmente o pH do sêmen deve ser mais alcalino, para que a acidez natural do canal vaginal possa ser neutralizada, evitando que os espermatozoides sejam danificados nesta parte do trajeto.
Cor, volume, viscosidade e tempo de liquefação também são aspectos importantes, uma vez que estão relacionados à capacidade do sêmen de nutrir, proteger e conduzir os espermatozoides após a ejaculação.
A motilidade espermática, ou seja, a capacidade de os espermatozoides se locomoverem pela vibração de suas caudas, é ativada com a liquefação do sêmen, que se torna menos viscoso e facilita a movimentação dos espermatozoides.
Além da capacidade de liquefação do sêmen, a motilidade espermática também depende da formação adequada das células reprodutivas masculinas, na espermatogênese, e o desenvolvimento completo da cauda, que acontece já nos epidídimos.
A motilidade espermática é um parâmetro avaliado pela capacidade ou não de movimentação da cauda espermática, na maior parte dos espermatozoides de uma amostra, mas também analisa se esse movimento leva o espermatozoide a se locomover progressivamente – o que é essencial para que o trajeto até o óvulo seja percorrido corretamente.
A morfologia espermática também é um parâmetro bastante significativo na avaliação da qualidade do sêmen.
A estabilidade no formato do espermatozoides é fundamental para direcionar o nado dessas células e conservar o acrossomo até o momento em que esta estrutura se rompe para liberar as enzimas que interagem com o óvulo e romper a zona pelúcida, para a fecundação.
O espermograma pode ser um dos primeiros exames masculinos solicitados para o casal que está tentando engravidar, inclusive àqueles que receberam indicação para tratamento com a reprodução assistida.
Entre as alterações que o espermograma pode indicar, todas podem estar em alguma medida, relacionadas à quadros de infertilidade masculina em diferentes graus de gravidade.
As principais condições identificadas pelo exame podem ser listadas a seguir:
Se ainda restaram dúvidas sobre o espermograma, toque neste link para ler mais sobre o assunto.
MaisA fertilidade masculina depende das principais variáveis: integridade do processo de formação dos espermatozoides nos testículos, bem como dos ductos que conduzem essas células para a formação do sêmen, e transporte na ejaculação. O sêmen é composto pelos espermatozoides e uma combinação de secreções produzidas […]
A fertilidade masculina depende das principais variáveis: integridade do processo de formação dos espermatozoides nos testículos, bem como dos ductos que conduzem essas células para a formação do sêmen, e transporte na ejaculação.
O sêmen é composto pelos espermatozoides e uma combinação de secreções produzidas pelas glândulas anexas do aparelho reprodutor masculino: próstata, vesículas seminais e glândulas bulbouretrais.
Chamada tecnicamente de espermatogênese, o desenvolvimento dos espermatócitos em espermatozoides é mediado pela testosterona e ocorre nas paredes dos túbulos seminíferos, que compõem a maior parte dos testículos.
Os túbulos seminíferos, por sua vez, estão conectados aos epidídimos, que recebem os espermatozoides ainda sem a cauda. Essa estrutura é desenvolvida nos próprios epidídimos, conferindo a motilidade necessária para que essas células consigam transitar pelo aparelho reprodutor feminino e alcançar o óvulo.
Os epidídimos também armazenam os espermatozoides e os conduzem aos ductos deferentes para que, no momento da ejaculação, encontrem os líquidos glandulares e o sêmen esteja finalmente formado.
A infertilidade masculina, portanto, pode ser resultado de alterações espermáticas e obstruções nessa rede de ductos que conduz os espermatozoides e o sêmen. Os quadros de azoospermia estão entre os mais graves, oferecendo risco inclusive de infertilidade permanente.
Quer entender melhor as diferentes formas de azoospermia e suas causas? Continue a leitura até o final e saiba mais!
Azoospermia é definida pela ausência de espermatozoides no sêmen ou líquido ejaculado. É uma condição que afeta a fertilidade dos homens, normalmente de forma severa.
Dependendo das causas da azoospermia, a condição pode estar envolvida com quadros de infertilidade primária, quando o homem nunca teve filhos e não consegue engravidar a parceira em função dessa condição e, também, de infertilidade secundária, quando a azoospermia aparece após o homem já ser pai.
O diagnóstico da azoospermia é feito pela análise do espermograma, um exame laboratorial que avalia a qualidade do sêmen utilizando uma amostra obtida por masturbação. Os resultados são comparados aos parâmetros espermáticos de normalidade estipulados pela Organização Mundial de Saúde (OMS).
Dependendo das causas da azoospermia, a condição pode ser dividida em dois tipos: azoospermia obstrutiva e azoospermia não obstrutiva.
Um dos tipos mais recorrentes de azoospermia é aquele causado pela obstrução no trajeto percorrido pelos espermatozoides até os ductos deferentes, quando se juntam os líquidos glandulares para a formação do sêmen.
Nesses casos, é comum que a espermatogênese aconteça sem maiores problemas, mas, mesmo íntegros, os espermatozoides permanecem retidos nos testículos e não compõem o sêmen. A ejaculação ocorre normalmente e o quadro de azoospermia obstrutiva só é identificado com a realização do espermograma.
A azoospermia obstrutiva pode ser resultado de malformações congênitas nos ductos que conduzem os espermatozoides e o sêmen, porém a maior parte dos casos é resultado da contaminação por microrganismos que provocam quadros infecciosos e inflamatórios.
As DSTs (doenças sexualmente transmissíveis) que provocam epididimite são a principal forma de acesso dos microrganismos ao aparelho reprodutor masculino. Muitas vezes essas infecções têm início com um quadro anterior de uretrite, que pode evoluir e atingir as estruturas que compõem o cordão espermático e os testículos.
Inicialmente, a atividade microbiana desencadeia um processo inflamatório, cujas consequências – alterações teciduais e edema – podem obstruir os ductos, principalmente os epidídimos.
Embora o tratamento ofereça bons resultados, tanto em relação à infecção como à desobstrução dos ductos, a demora em buscar atendimento pode fazer com que a infecção deixe cicatrizes, formando aderências que continuam obstruindo a passagem dos espermatozoides.
Nesses casos, a azoospermia obstrutiva pode provocar um quadro de infertilidade permanente, cuja reversão só é possível com os tratamentos oferecidos pela reprodução assistida.
Além das doenças mencionadas, a azoospermia obstrutiva pode ser um quadro provocado propositalmente, quando o homem decide pela vasectomia. O procedimento para esterilização masculina voluntária é feito pela interrupção dos ductos deferentes, fazendo com que o sêmen esteja livre de espermatozoides.
A azoospermia não obstrutiva normalmente é uma condição associada a doenças que prejudicam especificamente a função dos testículos e a produção de espermatozoides e, como o tipo obstrutivo, pode ser consequência de alterações genéticas e adquiridas ao longo da vida.
A varicocele está entre as principais causas da azoospermia não obstrutiva, ao lado dos desequilíbrios na secreção e processamento da testosterona, ambas de origem genética.
Causada pela formação de veias varicosas na rede vascular que irriga o cordão espermático, a varicocele provoca alterações no ambiente interno da bolsa escrotal que prejudicam a formação dos espermatozoides. As dificuldades de fluxo sanguíneo provocadas pela doença aumentam a pressão e a temperatura internas dos testículos comprometendo a espermatogênese.
Algumas condições genéticas provocam hipogonadismo hipogonadotrófico, condição que causa uma redução nas taxas normais de testosterona, levando a quadros em que os testículos se mostram subdesenvolvidos, e a espermatogênese não acontece. A síndrome de Kallmann é um exemplo de condição genética envolvida com o hipogonadismo e que tem a azoospermia não obstrutiva como consequência.
A azoospermia não obstrutiva também pode ser resultado de causas não genéticas, como a caxumba, uma infecção que atinge majoritariamente crianças e que provoca orquite, atingindo os testículos e comprometendo a espermatogênese.
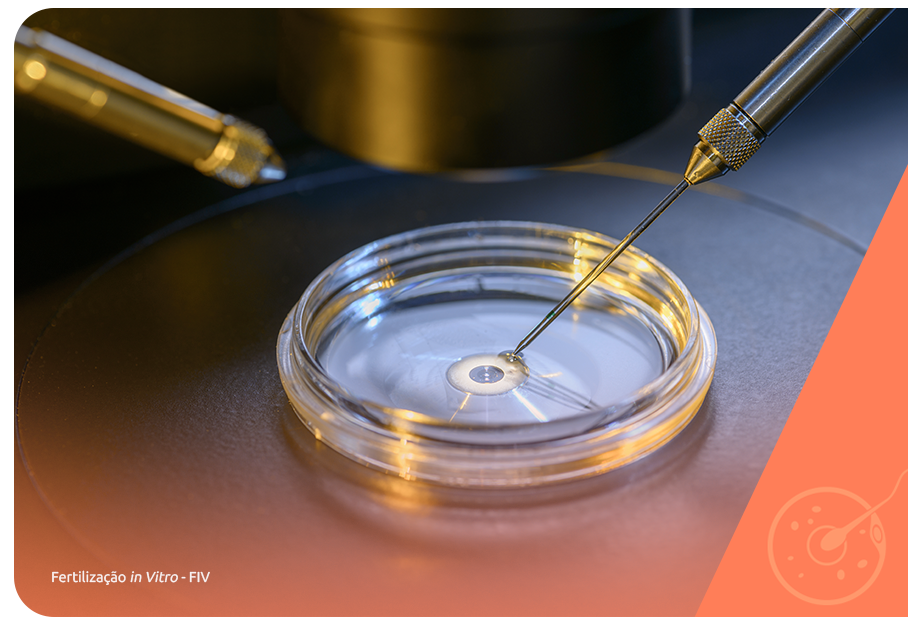
Muitos quadros de azoospermia obstrutiva e não obstrutiva podem ser revertidos por tratamentos primários se realizados de forma precoce, como a correção da varicocele e os tratamentos antibióticos para as diversas infecções que podem prejudicar a formação correta do sêmen.
A demora em realizar os tratamentos para essas condições pode provocar quadros mais graves, em que a infertilidade somente pode ser revertida com auxílio da reprodução assistida. As condições genéticas que provocam azoospermia, no entanto, não possuem tratamentos primários e recebem indicação direta para a reprodução assistida.
A FIV (fertilização in vitro) e a IA (inseminação artificial) são as únicas técnicas que permitem a abordagem da infertilidade masculina, por permitir níveis diversos de manipulação do sêmen. A FIV conta ainda com procedimentos complementares que viabilizam a coleta de espermatozoides diretamente dos testículos (recuperação espermática).
Ainda restam dúvidas sobre a azoospermia? Então, toque neste link e leia outro texto sobre o assunto.
MaisEngravidar nem sempre é um processo fácil e rápido, mesmo para casais sem qualquer diagnóstico que indique um quadro de infertilidade conjugal. Isso acontece porque os processos que envolvem a gravidez são complexos e dependem da interação entre diversas variáveis, especialmente entre as etapas de […]
Engravidar nem sempre é um processo fácil e rápido, mesmo para casais sem qualquer diagnóstico que indique um quadro de infertilidade conjugal.
Isso acontece porque os processos que envolvem a gravidez são complexos e dependem da interação entre diversas variáveis, especialmente entre as etapas de produção de células reprodutivas e nidação.
Embora todas as etapas da gestação sejam fundamentais para que o casal consiga engravidar, a nidação ou implantação embrionária é uma das mais importantes e, por isso, marca o início da gravidez propriamente dita.
Diferente do que muitos pensam, os problemas que podem prejudicar os processos da nidação ou implantação embrionária não estão restritos às doenças que afetam o aparelho reprodutivo feminino, mas podem também estar relacionadas à qualidade dos espermatozoides.
Continue a ler este texto e entenda melhor a importância dessa etapa para a fertilidade de homens e mulheres, inclusive nos tratamentos com a reprodução assistida.
No corpo feminino, todas as células reprodutivas são formadas ainda antes do nascimento e permanecem envolvidas pelos folículos, armazenados nos ovários, durante toda a infância e a vida reprodutiva da mulher até a menopausa.
Após a puberdade, um número específico de folículos é recrutado para participar da ovulação, a cada ciclo reprodutivo. Entre eles, apenas um, o folículo dominante, consegue chegar ao auge do crescimento e, ao romper-se, libera um óvulo maduro em direção às tubas em que pode ser fecundado.
Durante esse processo, a dinâmica dos hormônios sexuais também prepara o útero, mais especificamente o endométrio, camada de revestimento interno, para receber um possível embrião. O preparo endometrial envolve o espessamento e a complexificação da rede vascular desse tecido.
O óvulo permanece nas tubas por aproximadamente 24h e se o casal mantém relações sexuais sem o uso de preservativos no período próximo à ovulação, as chances de engravidar são mais altas.
Após a ejaculação, os espermatozoides seguem em direção às tubas e passam a disputar a entrada no interior do óvulo. Um deles consegue penetrar a zona pelúcida, um envoltório externo do óvulo com a função de impedir que mais de um espermatozoide participe da fecundação.
Quando a fecundação acontece, a cabeça do espermatozoide se desfaz no interior do óvulo, liberando o DNA espermático, para que encontre o DNA do óvulo, formando a primeira célula do futuro bebê (zigoto) com DNA completo herdado do pai e da mãe.
Esses eventos acontecem normalmente no interior das tubas uterinas, que após a formação do zigoto auxilia no transporte do embrião para o útero.
Durante o trajeto ao longo das tubas uterinas, o zigoto entra em processo de clivagem, divisões celulares que conservam a quantidade de DNA nas novas células formadas, aumentando de tamanho ainda envolto pela zona pelúcida herdada do óvulo.
O desenvolvimento embrionário inicial é dividido em fases, de acordo com as transformações na organização das células formadas pelas clivagens. A mórula é a primeira etapa desse processo e nessa fase o embrião é semelhante a uma amora, com todas as células unidas em um bloco maciço.
Normalmente, ao chegar ao útero, o embrião já atingiu o estágio de blastocisto, quando acontecem as primeiras diferenciações celulares. As células que formam o embrião alocam-se em um polo da zona pelúcida, enquanto as células que originam os anexos embrionários, placenta, líquido amniótico e cordão umbilical, se posicionam no polo oposto.
Quando o blastocisto encontra o endométrio, a comunicação bioquímica entre essas estruturas guia o embrião em busca do lugar mais adequado para realizar a nidação, também chamada implantação embrionária.
Nesse momento, a zona pelúcida se rompe (hatching), permitindo que as células embrionárias se infiltrem no tecido endometrial, fixando-se ao útero e iniciando a gestação propriamente dita.
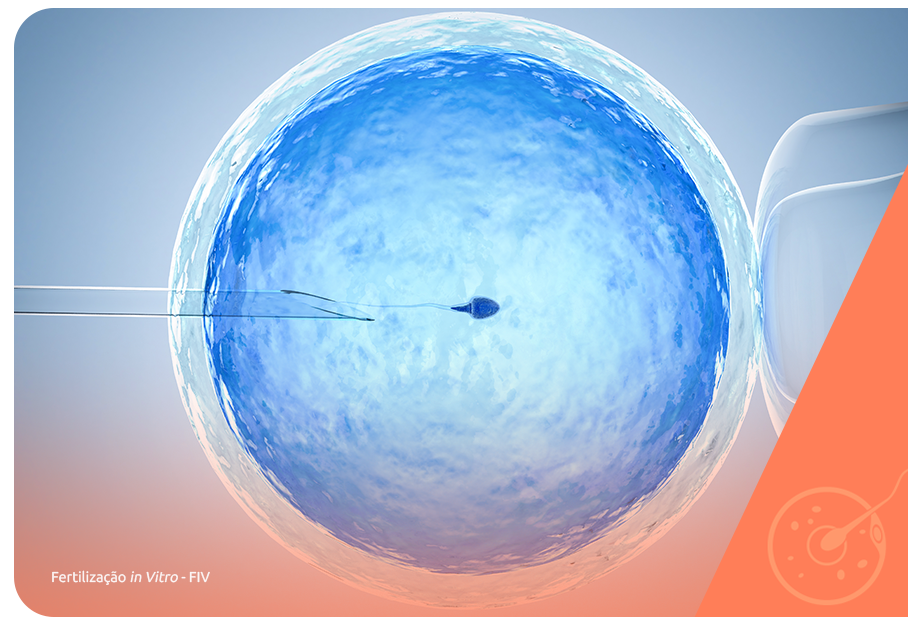
A nidação ou implantação embrionário é, como mencionamos, o marco inicial da gravidez e, por isso, acontece tanto nas gestações naturais como nos tratamentos com a reprodução assistida.
Embora as técnicas de reprodução assistida ofereçam graus diferentes de controle sobre os processos da gravidez a nidação é uma etapa sobre a qual têm pouca capacidade de intervir.
Nas técnicas de baixa complexidade, RSP (relação sexual programada) e IA (inseminação artificial), a nidação não pode ser controlada porque essas metodologias, embora diferentes uma da outra, contam com a fecundação nas tubas uterinas e a migração natural do embrião para o útero.
Na FIV (fertilização in vitro), que consegue reproduzir a fecundação em laboratório, é possível acompanhar o desenvolvimento embrionário inicial e os embriões selecionados são depositados diretamente no útero, que deve estar adequadamente preparado.
A possibilidade de manipulação dos embriões permite que uma pequena fissura seja aberta na zona pelúcida antes da transferência embrionária, o que chamamos assisted hatching para ajudar no rompimento dessa película.
O assisted hatching, contudo, não garante que a nidação aconteça, apenas diminui as chances de falha na implantação embrionária, melhorando as taxas de gestação da FIV em pacientes selecionadas.
A FIV é uma técnica complexa, que atualmente atende às mais diversas demandas reprodutivas. Toque neste link para conhecê-la melhor.
MaisEndométrio é o tecido de revestimento da cavidade uterina, que interage com a dinâmica hormonal do ciclo reprodutivo modificando-se nas diferentes fases. Por receber o embrião, quando a fecundação ocorre, e manter contato direto com a placenta durante toda a gestação, problemas nesse tecido podem […]
Endométrio é o tecido de revestimento da cavidade uterina, que interage com a dinâmica hormonal do ciclo reprodutivo modificando-se nas diferentes fases. Por receber o embrião, quando a fecundação ocorre, e manter contato direto com a placenta durante toda a gestação, problemas nesse tecido podem comprometer a fertilidade feminina.
O endométrio mantém contato direto também com o miométrio, camada muscular do útero que confere ao órgão as capacidades elástica e contrátil, igualmente fundamentais para a gestação e o parto.
Entre as doenças que envolvem o tecido endometrial, está a endometriose, que pode provocar infertilidade em algumas mulheres. Outra, é a adenomiose, que assim como a endometriose provoca a disparada de processos inflamatórios, mas em outro local. Essas doenças têm algumas semelhanças, mas provocam consequências diversas com funcionamentos também diferentes.
Continue a leitura até o final e entenda melhor a diferença entre a endometriose e a adenomiose.
Considerada uma das doenças estrogênio-dependentes mais recorrentes na população feminina em idade fértil, a endometriose provoca o aparecimento de focos de tecido endometrial ectópico, ou seja, que se desenvolvem fora da cavidade uterina.
Entre as principais estruturas afetadas pela endometriose podemos destacar os ovários, tubas uterinas, peritônio (tecido de revestimento da cavidade pélvica, em contato com todos os órgãos ali localizados), intestino e bexiga.
Os focos endometrióticos respondem à atividade do estrogênio crescendo e tornando-se inflamados. Tanto a inflamação como o aumento nas dimensões desses implantes podem prejudicar o funcionamento das estruturas as quais estão aderidos e alterar sua anatomia.
Também incluída no grupo das doenças estrogênio-dependentes, como a endometriose, os miomas uterinos e os pólipos endometriais, na adenomiose observamos uma invasão de tecido endometrial no interior do miométrio.
Essa invasão desestrutura principalmente a zona juncional, que faz a fronteira entre esses dois tecidos na parede uterina, mas, em alguns casos, pode se estender até a região subserosa do útero. Assim, além de provocar a inflamação do miométrio, alguns casos de adenomiose também podem afetar as funções do útero como um todo.
Como observamos em todos os processos inflamatórios do corpo, os tecidos que se encontram inflamados manifestam algumas alterações em comum: aumento da permeabilidade dos vasos sanguíneos, que leva à formação de edema (inchaço) e aumento na temperatura local.
Na adenomiose, essas alterações são provocadas pela atividade do estrogênio e estão por trás da maior parte dos sintomas da doença, especialmente dolorosos.
Embora o funcionamento dessas doenças possa parecer semelhante, já que ambas estão associadas a quadros inflamatórios estrogênio-dependentes envolvendo o tecido endometrial, suas diferenças são marcantes.
Enquanto na endometriose o endométrio se manifesta sempre fora do útero, na adenomiose a inflamação endometrial é provocada pela invasão desse tecido sobre a zona juncional, podendo ocupar diversos espaços no miométrio.
A adenomiose é, portanto, uma doença basicamente uterina e por isso produz sintomas exclusivamente uterinos, enquanto a endometriose pode se instalar em diversas estruturas principalmente da cavidade pélvica e pode provocar sintomas intestinais, urinários e alterações ovarianas, inclusive na ovulação.
Outra diferença importante entre essas doenças reside nos motivos que favorecem seus aparecimentos. A endometriose é comumente encontrada em mulheres com histórico familiar da doença, sugerindo uma predisposição genética. Já a adenomiose pode ser um quadro comum do pós-parto e no pós-cirúrgico de procedimentos uterinos, além dos casos em que se manifesta espontaneamente.
A relação entre a endometriose e a infertilidade feminina está mais bem esclarecida pela medicina e hoje é um consenso entre os profissionais da saúde, ainda que nem todas as formas da doença estejam envolvidas em quadros de infertilidade.
Normalmente, a maior parte dos casos em que a endometriose provoca problemas reprodutivos inclui principalmente os de endometriose ovariana, que produz cistos avermelhados chamados endometriomas.
O crescimento dos endometriomas e sua inflamação prejudicam a função ovariana, além de oferecer riscos à reserva ovariana, podendo diminuir o potencial de fertilidade da mulher.
A relação entre infertilidade e adenomiose, por outro lado, ainda não é um consenso entre os especialistas. Ainda que os casos mais graves normalmente recebam indicação para histerectomia, cirurgia de retirada do útero, que provoca infertilidade permanente, nem sempre a adenomiose é sintomática e prejudica a fertilidade.
A inflamação do miométrio pode atingir o endométrio e prejudicar a receptividade endometrial, que é a capacidade desse tecido em interagir com o embrião, favorecendo a nidação. Nesses casos, a mulher com adenomiose pode apresentar episódios isolados de abortamento e aborto de repetição.
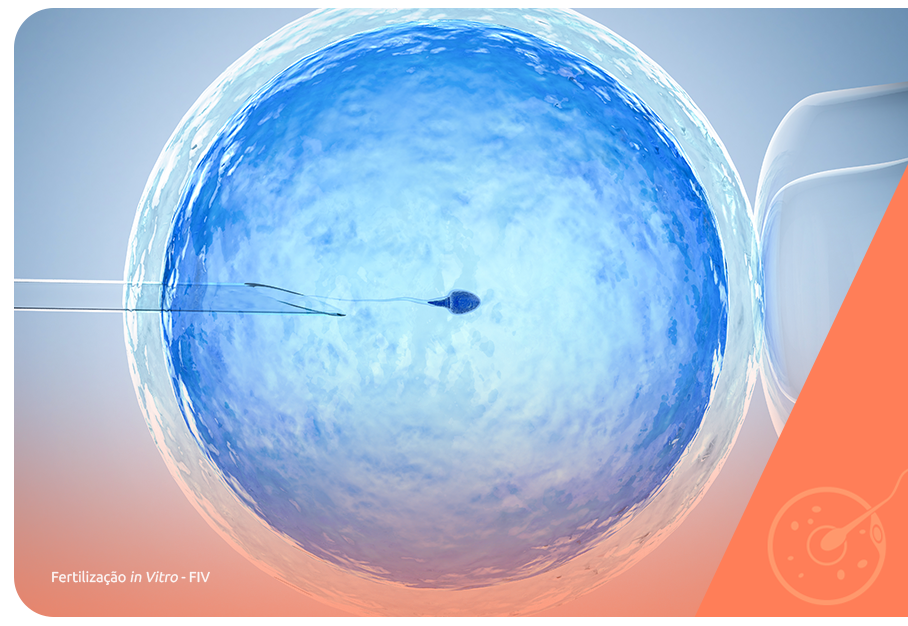
A reprodução assistida (RA) é um conjunto de técnicas que têm como principal objetivo auxiliar casais com problemas reprodutivos, casais homoafetivos e pessoas solteiras que desejam ter filhos.
Cada uma, RSP (relação sexual programada), IA (inseminação artificial) e FIV (fertilização in vitro), é indicada de acordo com as especificidades do caso.
A infertilidade por endometriose ovariana pode ser abordada por todas as técnicas de RA. As de baixa complexidade (IA e RSP) são indicadas para os casos mais leves da doença. A FIV, por ser mais complexa e abrangente, é adequada a todas as formas de infertilidade por endometriose, principalmente nos casos moderados/graves.
No caso da adenomiose, no entanto, a FIV pode atender melhor às demandas da doença, em alguns casos. Isso porque a infertilidade relacionada à adenomiose pode ser resultado de falhas na receptividade endometrial e a FIV permite o congelamento dos embriões para um preparo endometrial controlado por medicação hormonal.
Além disso, pode ser indicada para mulheres que perderam o útero em função da adenomiose, já que prevê a possibilidade de cessão temporária de útero, em que outra mulher gesta os embriões produzidos com os gametas dos pais.
Quer saber mais sobre a endometriose? Toque no link!
MaisA fertilidade das mulheres acontece de forma cíclica, ou seja, uma série de acontecimentos bioquímicos mediados pela atividade dos hormônios sexuais ocorrem sequencialmente, provocando modificações celulares importantes que permitem à mulher engravidar. No entanto, a gravidez não acontece em qualquer período do ciclo, já que […]
A fertilidade das mulheres acontece de forma cíclica, ou seja, uma série de acontecimentos bioquímicos mediados pela atividade dos hormônios sexuais ocorrem sequencialmente, provocando modificações celulares importantes que permitem à mulher engravidar.
No entanto, a gravidez não acontece em qualquer período do ciclo, já que a mulher fica realmente fértil apenas por alguns dias, normalmente próximos à metade do ciclo que começa com a chegada da menstruação.
O cálculo do período fértil deve considerar também uma variável importante, mas relativa à capacidade reprodutiva masculina: o tempo de sobrevivência do espermatozoide no interior do corpo da mulher.
Alguns aspectos do sêmen podem ajudar a prolongar a sobrevivência espermática, como o pH dos líquidos glandulares que é mais alcalino e por isso protege as células reprodutivas masculinas do ambiente naturalmente ácido do canal vaginal.
Este texto explica detalhadamente sobre o que é o período fértil e como seu cálculo pode ser utilizado para potencializar as chances de gravidez dos casais tentantes. Boa leitura!
As modificações hormonais e celulares que caracterizam o ciclo reprodutivo são organizadas em fases para uma melhor compreensão dos processos envolvidos, embora biologicamente esses eventos aconteçam de forma fluida.
Nesse sentido, convencionou-se que a chegada do sangue menstrual, no primeiro dia da menstruação, é o marco inicial de cada ciclo.
As duas estruturas que mais se modificam durante esse processo são os ovários, que armazenam a reserva ovariana e sediam a ovulação, e o útero, que se prepara para receber um possível embrião a cada ciclo.
A fase inicial do ciclo reprodutivo é chamada folicular porque um dos eventos centrais dessa etapa é o recrutamento dos folículos ovarianos, contendo um óvulo cada, para a ovulação. Embora muitos folículos sejam recrutados, na maioria das vezes somente um consegue chegar ao auge do desenvolvimento e participar da ovulação.
Esse processo é mediado principalmente pelas gonadotrofinas FSH (hormônio folículo-estimulante) e LH (hormônio luteinizante), secretadas pela hipófise e que interagem com as células foliculares para a produção de um terceiro hormônio, o estrogênio.
No início da menstruação, os níveis de estrogênio e progesterona são mínimos e isso desencadeia a retomada na produção de GnRH (hormônio liberador de gonadotrofinas), que estimula a hipófise.
Ao longo da fase folicular, a concentração das gonadotrofinas e do estrogênio aumenta gradativamente para viabilizar a ovulação e para reiniciar o preparo endometrial. Nesse sentido, o estrogênio é o principal hormônio do preparo endometrial na fase folicular e sua atividade leva ao espessamento do endométrio.
Após a ovulação, a dinâmica hormonal do ciclo reprodutivo se altera, principalmente com a formação do corpo lúteo, que inclusive dá nome a essa etapa, e o início da produção de progesterona.
O corpo lúteo responde principalmente à ação do LH, que mantém essa estrutura ativa por alguns dias depois que a ovulação ocorreu, levando a um aumento na concentração da progesterona.
Nos primeiros dias após a ovulação, os hormônios sexuais mais abundantes são o estrogênio e a progesterona. As altas taxas desses hormônios finalizam o preparo endometrial iniciado na fase folicular, assim como modifica a produção de GnRH e consequentemente de FSH e LH, impedindo que uma nova ovulação aconteça em um mesmo ciclo reprodutivo.
Com a diminuição do LH o corpo lúteo degenera, interrompendo a produção de progesterona. Nesse momento ocorre a finalização do preparo endometrial com o consumo da maior parte de estrogênio e progesterona circulantes.
Ao final da fase lútea, a queda na concentração de estrogênio e progesterona leva à descamação do endométrio excedente, produzido pelo preparo endometrial, que é expulso do corpo como sangue menstrual.
O evento que estabelece a fronteira entre a fase folicular e a fase lútea é a ovulação.
Para que a ovulação aconteça, as gonadotrofinas e o estrogênio devem atingir um pico máximo de concentração simultaneamente, provocando o rompimento do folículo dominante e a liberação do óvulo, já maduro, contido em seu interior.
Enquanto as células foliculares que restam aderidas ao ovário formam o corpo lúteo, iniciando a segunda fase do ciclo, o óvulo é direcionado para o interior das tubas uterinas, pelas fímbrias, e fica disponível para ser fecundado por 24h.
Portanto, em um ciclo considerado normal, que dura em média 28 dias, a ovulação acontece por volta do 14º dia após a chegada do sangue menstrual, caracterizando esse momento como o centro do período fértil.
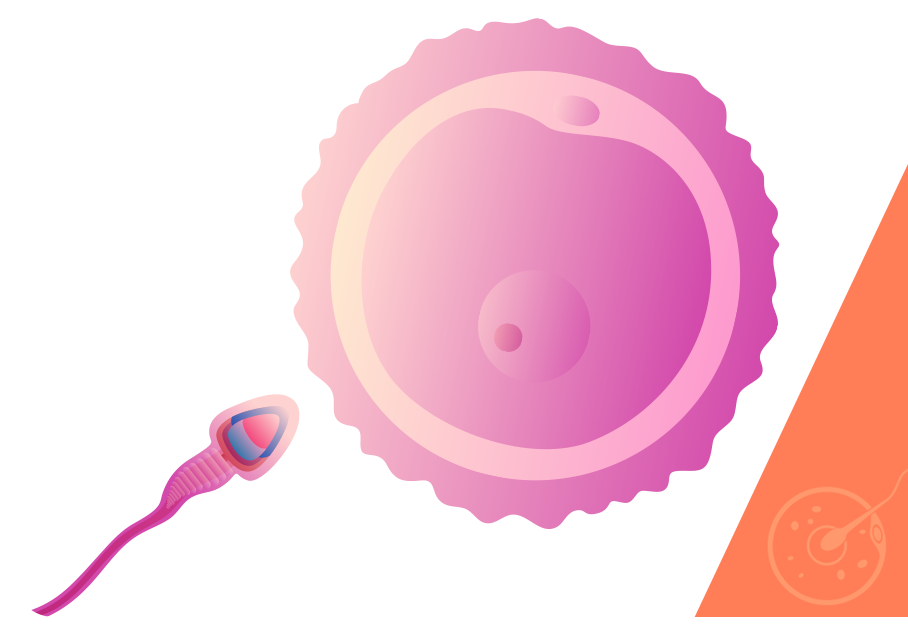
Como mencionamos, o cálculo do período fértil deve incluir uma variável masculina: o tempo de sobrevivência dos espermatozoides no interior do corpo da mulher, que é de aproximadamente 3 dias.
Ou seja, mesmo que o casal mantenha relações sexuais sem preservativos até três dias antes da ovulação, é possível que esses espermatozoides estejam ainda vivos nas tubas quando a liberação do óvulo acontecer e a fecundação pode ocorrer.
Assim, podemos dizer que o período mais fértil da mulher que apresenta um ciclo reprodutivo de 28 dias, vai do 11º ao 15º dias após a chegada do sangue menstrual.
O cálculo do período fértil pode potencializar as chances de que uma gravidez aconteça, porém não garante a fecundação, especialmente porque a maior parte das mulheres não apresenta sempre ciclos de 28 dias.
A irregularidade dos ciclos menstruais não necessariamente está ligada a qualquer distúrbio reprodutivo e é, na realidade, mais comum do que a predominância de ciclos regulares.
Nesse sentido, pelos mesmos motivos que o cálculo do período fértil não garante a gravidez, também pode se mostrar falho se for utilizado para evita-la, especialmente quando é o único método contraceptivo adotado pelo casal.
Geralmente, o casal sem problemas relacionados à infertilidade conjugal tem aproximadamente 20% de chance de engravidar mantendo relações sexuais durante o período fértil a cada ciclo reprodutivo.
Quer aprender a calcular seu período fértil e assim aumentar as chances de engravidar? Toque neste link!
Mais
